Изделия, подлежащие обязательной регистрации
Согласно статье 28 323-ФЗ госрегистрация изделий медицинского назначения обязательна для всех видов товаров, которые используются в целях:
- профилактики заболеваний и патологий;
- диагностики;
- лечения;
- реабилитации;
- предотвращения или прерывания беременности;
- других медицинских целях.
Классы потенциального риска
В зависимости от сложности, области применения и других факторов медицинские изделия различаются по критерию класса риска. Он представляет собой степень потенциального вреда, который товар способен нанести здоровью пациента даже при условии соблюдения рекомендаций производителя относительно его использования. По этому признаку выделяются классы:
- 1 – низкий;
- 2а – средний;
- 2б – повышенный;
- 3 – высокий.
Товары, не подлежащие постановке на учет
Невзирая на то, что действующее законодательство устанавливает требование об обязательной регистрации почти для всех товаров медицинского назначения, из этого правила есть некоторые исключения. Согласно пункту 5 статьи 38 323-ФЗ госрегистрация медицинского изделия не потребуется, если речь идет о товаре для использования конкретным пациентом. Их изготавливают в соответствии с характером его заболевания и рекомендациями его лечащего врача. Это минимизирует возможность применения такого продукта другими пациентами, поэтому ставить его на учет не нужно.
Порядок процедуры
С 1 января 2022 года Российская Федерация, как и другие страны-участницы Евразийского экономического союза, полностью перешла на общесоюзные правила госрегистрации и сертификации медицинских товаров. Они регулируются положениями решения Коллегии ЕЭК от 12.02.2016 № 46. В соответствии с ним регистрация медизделий в Росздравнадзоре предполагает последовательную реализацию следующих шагов.
- Заявитель организует необходимые испытания, оформляет и собирает требуемые документы и составляет регистрационное досье.
- Заявитель выбирает референтное государство, где будет подаваться заявки на госрегистрацию медицинского изделия, и государства признания, где медицинское изделие сможет обращаться после получения регистрационного удостоверения.
- Заявитель подает регистрационное заявление и досье в Росздравнадзор.
- Эксперты ведомства анализируют степень полноты и корректности оформления пакета и при отсутствии ошибок назначают экспертизу товара.
- Сотрудники уполномоченной экспертной организации проводят экспертизу, в рамках которого изучаются данные, содержащиеся в регистрационном досье. Результаты экспертизы оформляются экспертным заключением, которое передается в Росздравнадзор.
- Специалисты аккредитованной организации выполняют инспекцию производства медицинского изделия, в рамках которой проверяют соответствие оборудования, технологических процессов и других параметров установленным нормативам.
- Аккредитованная медицинская организация проводит клинические испытания, в ходе которых исследуются качество, безопасность и действенность продукта. Результаты испытаний оформляются протоколами установленного образца, которые передаются в Росздравнадзор.
- Сотрудники Росздравнадзора изучают полный пакет документов по изделию и, в случае положительной рекомендации, выданной медицинскими экспертами, размещают его в межгосударственной информационной системе для ознакомления сотрудниками уполномоченных органов государств признания.
- Сотрудники уполномоченных органов государств признания изучают документацию по изделию и принимают решение о ее согласовании.
- Потом Росздравнадзор принимает решение по государственной регистрации продукта. Если оно окажется положительным, сотрудники ведомства оформляют и выдают заявителю регистрационное удостоверение и вносят информацию об изделии в Единый реестр зарегистрированных продуктов.
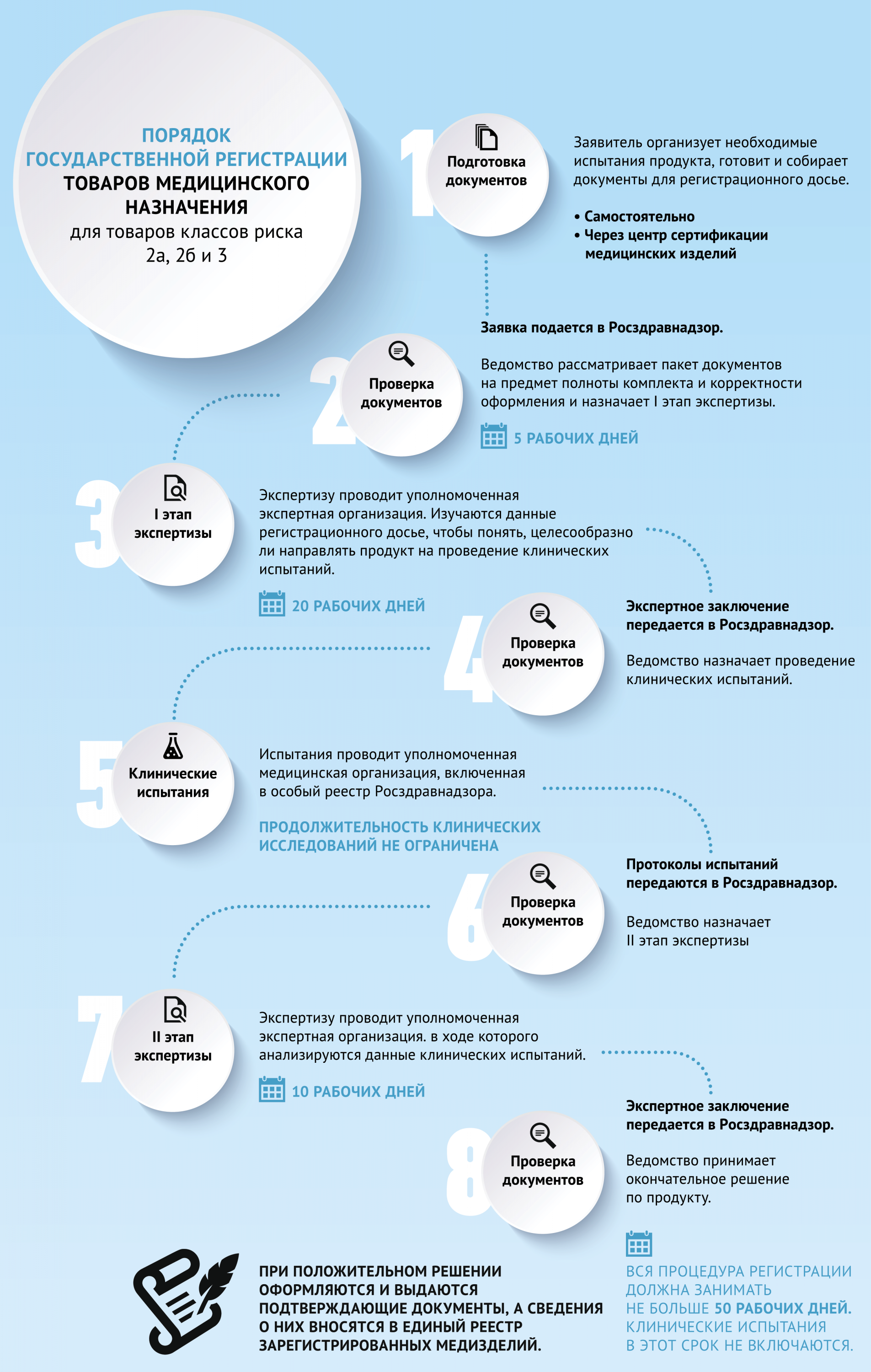
Сроки
Максимальная длительность регистрации складывается из нескольких компонентов:
- изучение комплекта документации на изделие и решение о начале процедуры регистрации – 5 рабочих дней;
- экспертиза регистрационного досье – 60 рабочих дней;
- инспекция производства изделия – 90 рабочих дней;
- согласование экспертного заключения уполномоченными органами государств признания – 30 календарных дней;
- принятие решения о регистрации изделия – 10 рабочих дней;
- оформление регистрационного удостоверения -10 рабочих дней.
Размер государственной пошлины
Согласно статье 333.32.2 действующего Налогового кодекса РФ стоимость регистрации становится суммой двух государственных пошлин:
- за выдачу регистрационного удостоверения – 11 тысяч рублей;
- за выполнение экспертизы – от 72 до 184 тысяч рублей в зависимости от класса риска изделия.
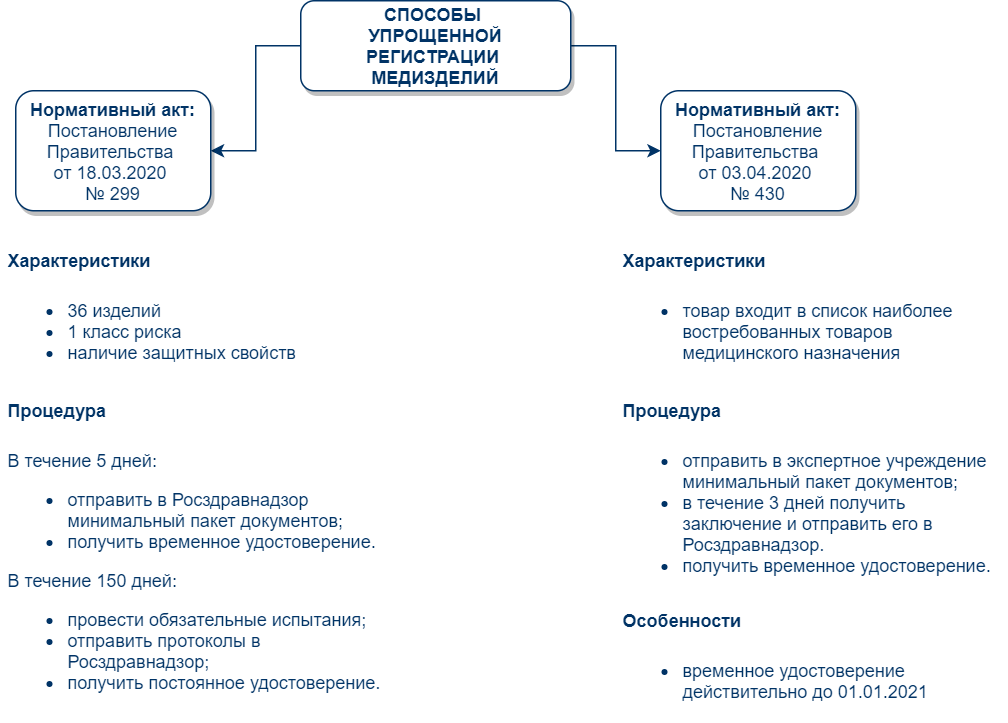
Распространенные ошибки при самостоятельной подаче заявки
Процесс взаимодействия с контролирующими государственными органами часто не приносит нужного результата. Основными ошибками, которые допускают заявители при самостоятельном обращении в Росздравнадзор, становятся:
- неполный или неправильно оформленный пакет документов на изделие;
- непроведение всех нужных испытаний;
- нарушение сроков подачи заявки;
- непредоставление дополнительной документации по запросу ведомства;
- другие ошибки.
Преимущества работы с нашим центром
Уполномоченный центр «Безопасность» предлагает помощь в регистрации врачебного изделия любой категории. Наши эксперты много лет сотрудничают с Росздравнадзором в этой области и знают все требования, действующие на текущий момент. Благодаря этому Ваша заявка будет удовлетворена с первого раза, и Вы оперативно пройдете государственную регистрацию, выведете товар на рынок и займете достойное место среди ведущих производителей.
|
Категория виновного лица |
Санкции за производство или продажу медизделия, не поставленного на учет |
Санкции за продажу медизделия, не поставленного на учет, через интернет |
|
Рядовой сотрудник |
70-100 т.р. |
75-200 т.р. |
|
Представитель руководящего состава |
100-600 т.р. |
150-600 т.р. |
|
ИП |
100-600 т.р.или остановка работы до 90 суток |
150-600 т.р.или остановка работы до 90 суток |
|
Юрлицо |
1-5 млн.р.или остановка работы до 90 суток |
2-6 млн. р. или остановка работы до 90 суток |


