Что собой представляет надлежащая практика?
Обязательное требование, которому стремятся отвечать все крупные производства лекарственных средств с мировым именем – соответствие стандарту GMP, или good manufacturing practice (надлежащая производственная практика). Нормативы данной системы правил применяются для следующих направлений деятельности по изготовлению:
- лекарственных средств;
- медицинских товаров, используемых для диагностики, профилактики и лечения заболеваний и иных патологических состояний, а также осуществления реабилитации пациентов;
- лечебных продуктов питания и компонентов, используемые при их производстве;
- биологически активных добавок.
При этом новая версия сертификации GMP распространяется на перечисленные категории продукции. Но этот стандарт – не единственный компонент семейства правил, ориентированных на обеспечение высокого качества и эффективности лекарственных средств и других товаров, применяемых в медицинских целях. В это семейство входят следующие стандарты:
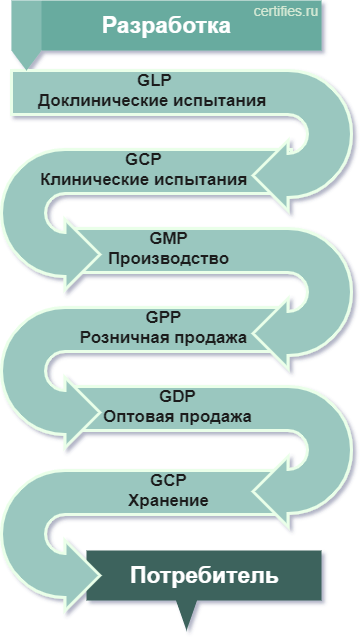
- Good Laboratory Practice (GLP) – нормативы для применения в лабораторной работе;
- Good Clinical Practice (GCP) – нормы надлежащей клинической практики;
- Good Distributon Practice (GDP) – стандарты осуществления приемлемой деятельности в области дистрибьюции товаров;
- Good Agricultural and Collection Practice (GACP ) – нормативы, применяемые при осуществлении культивирования и сбора лекарственных растений.
Правовая база
В Российской Федерации активно применяются правила GMP. Но при их применении необходимо учитывать особенности национальной экономики и условий работы фармацевтических и иных компаний, работающих в данной отрасли. Поэтому оценка соответствия лекарственных средств стандартам в России выполняется на основании национальных нормативных документов, в список которых входят:
- Национальный стандарт РФ ГОСТ Р 52249-2009, определяющий правила производства и выполнения контроля качества лекарственных средств;
- Постановление Правительства от 5 июня 2008 года № 438 с учетом последних изменений, которое определяет полномочия Министерства промышленности и торговли в этой области;
- Постановление Правительства от 3 декабря 2015 года № 1314, вводящее правила оценки соответствия изготовителей требованиям надлежащей производственной практики в Российской Федерации;
- Приказ Минпромторга от 14 июня 2013 года № 916, устанавливающий порядок применения этих требований и определяющий, как получить сертификат GMP в России;
- Приказ Минпромторга от 26 мая 2016 года № 1714, регламентирующий правила предоставления государственной услуги по подтверждению соответствия производителя требованиям надлежащей производственной практики;
- Приказ Минпромторга России от 17.12.2015 № 4119, который определяет правила ведения Единого государственного реестра, содержащего данные о том, какие лекарства имеют сертификат качества GMP на территории нашей страны.
Одновременно в настоящий момент осуществляется внедрение надлежащей практики производства лекарственных средств в Евразийском экономическом союзе, членом которого является и Россия. Сейчас для этих целей уже принято Решение Совета ЕЭК от 3 ноября 2016 года N 77, вводящее правила GMP на территории ЕАЭС.
Однако в ЕАЭС данная процедура пока еще находится в стадии становления. Это касается и нормативной базы, необходимой для полноценного внедрения стандартов качества лекарственных средств. Так, сейчас для этого требуется принятие решения Правительства о порядке осуществления отдельных процедур, касающихся выполнения фармацевтических инспекций. Приказ № 2945 о сертификации GMP, аналог российского приказа №916 от Минпромторга, вступит в силу только после принятия этого постановления, которое пока не опубликовано.
Преимущества оценки соответствия по GMP
Крупные международные производители не зря тратят массу сил и средств на прохождение сертификации лекарственных средств по правилам надлежащей практики производства. Это приносит им весомые преимущества, которые многократно окупают произведенные затраты. Как показывает практика, самыми важными из них являются:
- возможность участия в крупных коммерческих тендерах и государственных конкурсах, организаторы которых всегда обращают внимание на то, какие производители имеют сертификат соответствия GMP на производимые медицинские товары. Более того, в отдельных случаях наличие такого сертификата становится обязательным условием участия;
- повышение доверия конечных потребителей лекарственных средств;
- обеспечение стабильности качества продукции;
- расширенные возможности для выхода на зарубежные рынки, включая самые привлекательные рынки, расположенные в развитых странах;
- повышение интереса инвесторов к реализации проектов компании по расширению производства.
Международный сертификат надлежащей практики
Процедура оценки соответствия требованиям надлежащей производственной практики в зарубежных странах осуществляется аккредитованными сертификационными органами. При ее проведении международный центр сертификации лекарственных средств оценивает следующие параметры:
- соответствие технологии производства требованиям безопасности, обеспечивающим отсутствие риска попадания посторонних компонентов в продукт;
- соблюдение технологии производства на предмет выполнения обязательных технических требований, влияющих на качество продукта, таких как температура производственного помещения, его влажность и иные параметры;
- выполнение нормативов в отношении действенности, безопасности и качества лекарственных средств, установленных на государственном уровне;
- соответствие производства и готовой продукции обязательным требованиям стандарта GMP.
Российская система надлежащей практики
В России получение сертификата производится по несколько иной схеме. Ее основные параметры зафиксированы в постановлении Правительства № 1314. Государственным органом, который занимается предоставлением этой услуги, является Министерство промышленности и торговли. Необходимые в рамках процедуры исследования и экспертизы выполняет уполномоченная организация - ФГБУ «ГИЛС и НП». Для каждого специалиста, задействованного в выполнении испытаний, обязательна аттестация эксперта по GMP и наличие соответствующего сертификата.
Процедура сертификации в России
Общий алгоритм сертификации на соответствие стандартам надлежащей производственной практики в нашей стране включает последовательное прохождение заявителем следующих шагов.
- Контроль производства на соответствие действующим требованиям и правилам – своими силами или с привлечением уполномоченного консультанта. При необходимости – модернизация и изменение параметров производства с тем, чтобы обеспечить такое соответствие.
- Оформление необходимых документов, подтверждающих выполнение установленных требований.
- Подача заявки в Минпромторг.
- Ожидание назначения и проведения экспертизы производства и готовой продукции уполномоченной экспертной организацией.
- Ожидание окончательного решения о сертификации на основании результатов проведенных экспертиз и исследований.
- В случае положительного решения – получение сертификата GMP.
Необходимые документы
Для подачи заявки в Минпромторг согласно действующим правилам соискателю потребуется оформить и собрать следующие необходимые документы:
- копия доверенности, подтверждающей полномочия на подачу заявки;
- копия досье на объект производства лекарственных средств, в отношении которых производится сертификация;
- сведения о выявлении проблем с качеством товара или фактах отзыва продукта из торгового оборота за последние два года;
- полный перечень лекарственных средств, которые производятся на данном предприятии;
- копия лицензии на изготовлении медикаментов;
- согласие на выполнение инспекции предприятия.
Сроки
В соответствии с правилами, определенными постановлением № 1314, для каждого этапа сертификации устанавливаются следующие сроки.
|
Этап сертификации |
Максимальная длительность |
|
Контроль представленных документов, назначение экспертизы |
10 рабочих дней |
|
Направление данных о назначении экспертизы в уполномоченную организацию |
3 рабочих дня |
|
Проведение необходимых экспертиз и исследований |
160 рабочих дней |
|
Вынесение решения о сертификации |
10 рабочих дней |
160 дней, отведенных на выполнение исследований, включают и период ожидания в очереди из претендентов. Сама процедура занимает не больше 10 рабочих дней.
Согласно актуальным правилам срок действия сертификата GMP, выданного в России, составляет 3 года. При этом срок действия иностранного сертификата GMP зависит от страны выдачи и составляет от 1 года до 3 лет.
Стоимость
Стоимость процедуры состоит из двух компонентов:
- фиксированная госпошлина за рассмотрение заявления Минпромторгом, которая составляет 7,5 тысяч рублей;
- переменная величина стоимости экспертизы, которая зависит от сложности сертифицируемого объекта и других факторов. Правила ее расчета определены приказом Минпромторга от 11.01.2016 № 9.
Преимущества сотрудничества с нами
Центр сертификации «Безопасность» специализируется на предоставлении сертификационных услуг, включая процесс сертификации по стандартам и правилам GMP. Наши специалисты отлично знакомы с требованиями к соискателям. Мы проведем предварительный анализ Вашего предприятия на предмет соответствия действующим стандартам и правилам и порекомендуем, какие изменения следует внести в производственный процесс, чтобы с первого раза получить сертификат. Также мы поможем собрать и оформить необходимые документы и обеспечим контроль обработки Вашей заявки, включая соблюдение сроков выдачи сертификационной документации и правильность ее оформления.

